Uitgelicht
Duidelijkheid over dosering voor zwangeren op komst
De effectiviteit en veiligheid van geneesmiddelen voor zwangeren is nauwelijks onderzocht, waardoor over de juiste dosering veel onduidelijkheid heerst. Het eerste gerichte doseeradvies van Moeders voor Morgen Lareb betekent een stap op weg naar betere gefundeerde doseeradviezen voor zwangeren.
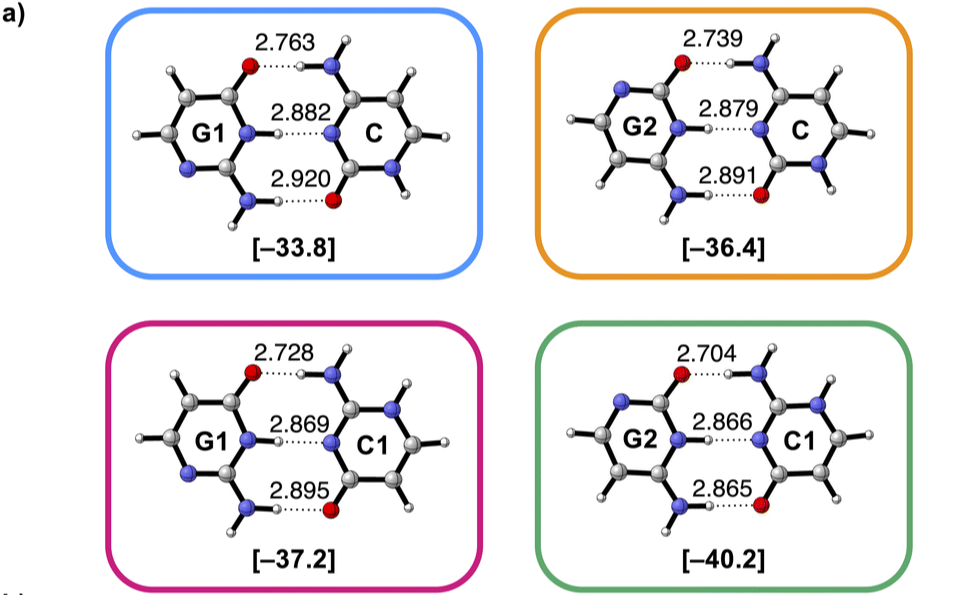
Héle molecuul beïnvloedt waterstofbrug
De mate van aantrekking in waterstofbruggen tussen twee moleculen wordt ook beïnvloed door de overige atomen in dat molecuul.
ECB 2024: Tips van kenners
Wat moet je niet missen tijdens ECB 2024? De redactie van C2W | Mens & Molecule verzamelt tips van insiders.
Doe-het-zelven met eiwitbouwblokken
Als je een huis bouwt of een boekenkast van IKEA in elkaar zet, gebruik je vaak standaardonderdelen. Dat kan nu ook met eiwitten, laten Amerikaanse onderzoekers zien in Nature.
Groene alanine met elektroflowchemie
Met een combinatie van flow- en elektrochemie kun je het aminozuur alanine op een groenere manier synthetiseren dan door fermentatie.
PFAS-filtermoleculen om door een ringetje te halen
Met gefunctionaliseerde ringvormige moleculen kun je PFOS en PFOA zeer efficiënt en selectief uit het water filteren.
ECB 2024: Plenaire spreker Michael Köpke
In de aanloop naar ECB 2024 praten we alvast bij met plenaire spreker Michael Köpke van LanzaTech.
Stengelsap en gezonde oliën
Bij het lectoraat Biobased Innovations van de HAN, Hogeschool van Arnhem en Nijmegen, zetten ze bioraffinage in om zoveel mogelijk waarde uit plantaardige reststromen te creëren. Met als ultieme doel: zero waste.
Runderbot of potvistand? Collageen onthult oorsprong
Extreem kleine eiwitmonsters blijken voldoende om met LC-MS de biologische oorsprong van ivoor in museale objecten te bepalen. ’Ondanks de ouderdom van het materiaal zijn er nog voldoende eiwitten aanwezig die kunnen leiden tot een positieve taxonomische identificatie.’
We can announce the first keynote speaker of Lab Technology 2024!
Lab Technology 2024: Explore the future of laboratory research
Analytical Solutions: een nieuw congres voor Analytische Wetenschappen
De toekomst van veilig en gezond werken in laboratoria
Ontmoet de sprekers van de SAC CE werkgroep op Analytical Solutions 2024
NelfKoopmans slaat een digitale slag en koppelt labdata aan verfproductie
Chemische producten: een onvermijdelijk risico in het laboratorium
- Previous
- Next
- Previous
- Next
LIMS houdt alles in de gaten
Diergeneesmiddelenproducent Dopharma koos voor LabWare als leverancier van hun nieuwe laboratory information management system. ‘Het is echt te veel geworden om dit zelf bij te houden.’
Oplichtend perovskiet maakt lood zichtbaar
Start-up Lumetallix biedt een eenvoudige testkit die loodsporen overal betrouwbaar en snel zichtbaar maakt. En dat dankzij een verrassende ontdekking uit oorspronkelijk zonnecelonderzoek.
DNA Factory krikt productie spectaculair op
Automatisering is niet alleen hot, maar ook nog eens nuttig als je veel wilt produceren maar niet al je mankracht op productie wilt zetten. De DNA-fabriek van Synchron Lab en Festo is hier een mooi voorbeeld van.
Bacterievijand levert nieuw wapen tegen resistentie
Obulytix, spin-off van UGent en KU Leuven, ziet in eiwitten uit bacteriedodende virussen de oplossing het groeiende probleem van antibioticaresistentie.
Ons Kent Ons 2024
Wie heeft er een prijs gewonnen? Wie kreeg die subsidie? Of wie heeft er een nieuwe positie gekregen? In Ons kent Ons houden we je op de hoogte van deze personalia.
Ook nieuws voor onze rubriek? Mail dan naar oko@kncv.nl
Gevoelige kanalen
Kinderproefje voor volwassenen
Oerwoud in een kolf
Evolutie van een mesosfeergeest
Kralenparade
- Previous
- Next
Oproep voor vrijwilligers voor KVCV
Marjan Sewradj met pensioen
De Next Step in je carrière
25 jaar NCCC
NBV-nieuws maart
- Previous
- Next
Steeds vaker
Kijk goed naar de cijfers achter een verhaal, waarschuwt Enith Vlooswijk. Zonder verdere context kun je percentages en getallen niet goed duiden.
‘Geen nieuwe academische samenwerkingen met fossiele bedrijven niet gecommitteerd aan Parijs’
Fossiele bedrijven geven voorrang aan de kortetermijnbelangen van hun aandeelhouders en werken zo de energietransitie tegen. Voor universiteiten is samenwerking met deze partijen daarom geen optie, vinden Geert-Jan Kroes en Philipp Gramlich.
‘Een bloeiende chemische industrie en een duurzame samenleving gaan hand in hand’
Jaag de chemische industrie niet weg, want het is een noodzakelijke partner om de wereld duurzamer te maken, betoogt Christophe De Bie. Chemische ongeletterdheid moet niet de boventoon voeren.
Etiketten
Naar aanleiding van een oproep door Nature aan ingenieurs om vooral hun onderzoek naar het tijdschrift te sturen, vraagt hoofdredacteur Esther Thole zich af hoe we eigenlijk onderscheid maken tussen science en engineering. En of dat wel zinvol is.
Duidelijkheid over dosering voor zwangeren op komst
De effectiviteit en veiligheid van geneesmiddelen voor zwangeren is nauwelijks onderzocht, waardoor over de juiste dosering veel onduidelijkheid heerst. Het eerste gerichte doseeradvies van Moeders voor Morgen Lareb betekent een stap op weg naar betere gefundeerde doseeradviezen voor zwangeren.
Scherper zicht op de kosten van chemisch recyclen
Wie de kosten van een nieuwe chemische plasticrecyclinginstallatie wil inschatten, kan het beste kijken naar energieverlies, blijkt uit recent onderzoek. Mogelijk kan dat simpele gegeven gaan helpen om grootschalige plasticrecycling via de petrochemie vlot te trekken.
In het klimaatbos groeien de bomen niet tot in de hemel
Bedrijven en overheden rekenen zich veel te rijk met plannen voor het afvangen van koolstofdioxide met bosaanplant en energiegewassen, waarschuwen onderzoekers in Science.
Kleinste PFAS: meer mensenhand dan moeder natuur
Trifluorazijnzuur (TFA) wordt volgens sommigen ook in de natuur gevormd. Chemici zijn daar inmiddels niet meer zo zeker van, omdat er twijfels zijn over eerder onderzoek.
Agenda
Rolduc meeting on Mass Spectrometry
Joint meeting of the NVMS (Netherlands) and BSMS (Belgium)
11th Life Science Symposium
Altering Evolution: Taking the future in our own hands
To bond or not to bond?
Brightlands Polymer Days 2024
Lab Technology 2024
Explore the future of laboratory research
Tatoeages: onschuldige decoratieve trend of gevaar voor de gezondheid?
Avondlezing door ing. D.J. Schakel georganiseerd door de Haarlemse Chemische Kring
Dossier: de sneaker
Sportief en stoer, maar zacht voor je voeten. De sneaker dankt zijn bestaan aan de reactie van zwavel met latex uit de rubberboom. Dat zorgde voor de komst van stevig, elastisch en bijna geruisloos rubber, ideaal voor een sportzool. Met gemiddeld 65 onderdelen en tien verschillende soorten vaak synthetische materialen vormen sneakers helaas ook een grote afvalhoop.
Dossier: anammox
Het begon rond 1990 met een opmerkelijke observatie in een proefwaterzuivering van Gist-Brocades, waar door een onbekend proces stikstofgas werd gevormd. Pas na jaren van volhardend experimenteren door onderzoeksgroepen in Delft en Nijmegen kwamen de eerste anammox-bacteriën in beeld.
Dossier: Cannabis
Cannabisproducten kunnen verlichting brengen bij uiteenlopende aandoeningen en symptomen. Maar gecontroleerd gebruik blijft belangrijk.
Dossier: Zweedse elementen
In dit dossier lees je over de ontdekking, de toepassingen en de uitdagingen van het scheiden van een groep zeldzame aardmetalen die in Zweden zijn ontdekt.
Dossier: Zeolieten
In dit dossier lees je over zeolieten: een speeltuin voor chemici. De industrie gebruikt synthetische zeolieten als ionenwisselaars, katalysators en adsorbens, maar nu we zoeken naar andere grondstoffen, hebben we ook andere zeolieten nodig.
Dossier: Kweekvlees
Eén gram koeienspier, duizenden hamburgers: kweekvlees is misschien wel de meest ambitieuze en kansrijke vleesopvolger van allemaal. De voordelen ten opzichte van de bio-industrie zijn in potentie enorm, maar heeft de consument er ook trek in?
-
Chemisch procesoperator 5-ploegendienst - Oss
-
Chemisch/Fysisch analist in de tuinbouw - Honselersdijk
-
Docent natuur- / scheikunde (2e graads) - Waalwijk
-
Laboratoriumtechnicus Vasculaire diagnostiek - Leeuwarden
-
QC Laborant - Tiel
-
Operator Chemie Kunstmest - Amsterdam
-
Nat Chemisch Laborant 2 ploegen - Rotterdam
-
Procesoperator Chemie 5-ploegenrooster - Hendrik-Ido-Ambacht
Stephan Hacker – Zoektocht naar zwakke plekken in bacteriën
Maurits de Roo – Chemische reacties met elektriciteit in plaats van chemicaliën
Pascal Vermeeren – Chemische mysteries ontrafelen met nieuwe modellen
Nico Claassens – Producten van de toekomst maken uit CO₂ met bacteriën
Tassos Perrakis – Eiwitten voor het volk
Alina Chanaewa – Scheuren in koolstofvezelcomposiet detecteren
- Previous
- Next